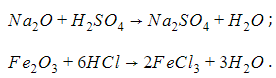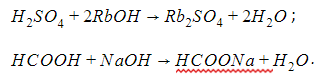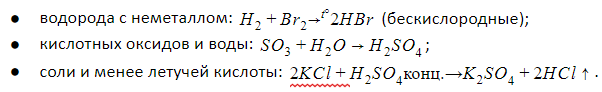Содержание
Кислоты в химии – это группа соединений, обладающих общими чертами в строении молекул, в состав которых всегда входит водород и кислотный остаток. В химических процессах кислоты проявляют специфические свойства, главное из которых – способность образовывать соли.
Определение и формулы
Кислота – соединение, молекулы которого способны к обмену или замещению водородного катиона ![]() (протона) катионом металла
(протона) катионом металла ![]() с присоединением его к кислотному остатку. В химических реакциях кислотный остаток, состоящий из одного (простой) или нескольких (сложный) атомов, сохраняет свой состав.
с присоединением его к кислотному остатку. В химических реакциях кислотный остаток, состоящий из одного (простой) или нескольких (сложный) атомов, сохраняет свой состав.
Химические формулы
В неорганической химии общая формула кислот имеет вид ![]() где H – водород, n – количество атомов, A – кислотный остаток.
где H – водород, n – количество атомов, A – кислотный остаток.
Значение n соответствует валентности кислотного остатка. Формула кислоты позволяет установить состав соединений, образуемых с ее участием, и составить уравнение реакции.
Органические карбоновые кислоты имеют общую формулу RCOOH, где R – углеводородный радикал, COOH – карбоксильная группа, атом водорода в составе которой может замещаться.
Ионные формулы
При растворении в воде происходит диссоциация – разложение – молекул кислоты на катионы H+ и анионы кислотных остатков. Поэтому кислоту можно представить в ионной записи ![]() . Так,
. Так, ![]() – ионный состав соляной кислоты
– ионный состав соляной кислоты ![]() – серной кислоты H2SO4;
– серной кислоты H2SO4; ![]() – ортофосфорной кислоты H3PO4.
– ортофосфорной кислоты H3PO4.
Диссоциация молекул карбоновых кислот происходит по схеме ![]() . Например, ионная формула пропионовой кислоты CH3CH2COOH имеет вид
. Например, ионная формула пропионовой кислоты CH3CH2COOH имеет вид ![]() .
.
Структурные формулы
Взаимное расположение атомов и кратность связей в молекуле отражают графические, или структурные, формулы:
| Кислота | Структурная формула | Трехмерная модель молекулы |
| плавиковая HF | 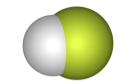 |
|
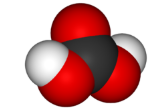
| угольная H2CO3 | 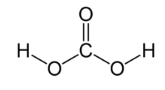 |
 |
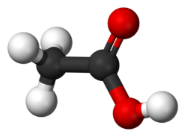
| уксусная CH3COOH |  |
 |
Классификация кислот в химии
Кислоты подразделяются на группы по ряду признаков:
- Состав кислотного остатка:
-
- бескислородные (HBr, HI, H2S);
- кислородсодержащие (HNO3, HClO4, H2SiO3).
- Основность – количество замещаемых водородных атомов (величина n в общей формуле HnA). Различают одно-, двух-, трех- и многоосновные кислоты.
- Сила (способность к отдаче протонов H+):
-
- Сильные – имеют высокую степень диссоциации (HI, HNO3, H2SO4). Самая сильная кислота в химии, поддающаяся хранению – органическая фторированная карборановая кислота H(CHB11F11). Большинство неорганических кислот характеризуются большей силой, чем органические.
- Слабые – диссоциируют в малой степени (H2S, H2CO3, HClO). Чем прочнее связь водорода с кислотным остатком, тем слабее кислота. Свинцовистая кислота H2PbO2 – самая слабая кислота в химии неорганических соединений.
Силу кислородсодержащих кислот с формулой ![]() определяют по разности m – n:
определяют по разности m – n:
| m – n | Сила | Примеры |
| 0 | очень слабая | HClO, H3AsO3 |
| 1 | слабая | H2CO3, H2SiO3, H3PO4 |
| 2 | сильная | HNO3, HClO3, H2SO4 |
| 3 | очень сильная | HClO4, HMnO4 |
Кислоты классифицируют также по растворимости, летучести и устойчивости.
Номенклатура
Систематические наименования бескислородных кислот строятся по следующему правилу: название элемента + суффикс «-о-» + «-водородная» (бромоводородная HBr ).
Наименование кислородсодержащей кислоты определяют особенности состава:
- Степень окисления кислотообразующего элемента:
- Содержание кислорода:
| выше | приставка «орто-» + название кислоты | |
| ниже | приставка «мета-» + название кислоты |
Кислоты, их соли и ангидриды
Названия и состав некоторых кислот, их солей (наименования кислотных остатков) и ангидридов (кислотных оксидов) представлены в таблице:
| Неорганические | |||||
| Кислота | Формула | Кислотный остаток и его валентность | Кислотный оксид | ||
| Бескислородные | |||||
| одноосновная | фтороводородная (плавиковая) | HF | F- (I), фторид | — | |
| хлороводородная (соляная) | HCl | Cl- (I), хлорид | — | ||
| бромоводородная | HBr | Br- (I), бромид | — | ||
| йодоводородная | HI | I- (I), йодид | — | ||
| двухосновная | сероводородная | H2S | S2- (II), сульфид | — | |
| селеноводородная | H2Se | Se2- (II), селенид | — | ||
| Кислородсодержащие | |||||
| одноосновная | азотистая | HNO2 | NO2- (I), нитрит | оксид азота (III) | |
| азотная | HNO3 | NO3- (I), нитрат | оксид азота (V) | ||
| хлорноватистая | HClO | ClO- (I), гипохлорит | оксид хлора (I) | ||
| хлористая | HClO2 | ClO2- (I), хлорит | оксид хлора (III) | ||
| хлорноватая | HClO3 | ClO3- (I), хлорат | оксид хлора (V) | ||
| хлорная | HClO4 | ClO4- (I), перхлорат | оксид хлора (VII) | ||
| марганцовая | HMnO4 | MnO4- (I), перманганат | оксид марганца (VII) | ||
| двухосновная | сернистая | H2SO3 | SO32- (II), сульфит | оксид серы (IV) | |
| серная | H2SO4 | SO42- (II), сульфат | оксид серы (VI) | ||
| угольная | H2CO3 | CO32- (II), карбонат | оксид углерода (IV) | ||
| кремниевая | H2SiO3 | SiO32- (II), силикат | оксид кремния (IV) | ||
| хромовая | H2CrO4 | CrO42- (II), хромат | оксид хрома (VI) | ||
| трехосновная | ортофосфорная | H3PO4 | PO43- (III), (орто)фосфат | оксид фосфора (V) | |
| (орто)борная | H3BO3 | BO33- (III), (орто)борат | оксид бора (III) | ||
| мышьяковая | H3AsO4 | AsO43- (III), арсенат | оксид мышьяка (V) | ||
| Органические | |||||
| Кислота | Формула | Кислотный остаток и его валентность | |||
| одноосновная | муравьиная | HCOOH | HCOO- , формиат | ||
| уксусная | CH3COOH | CH3COO- , ацетат | |||
| двухосновная | щавелевая | HOOC-COOH | -OOC-COO- , оксолат ((C2O42-) | ||
Свойства кислот
В стандартных условиях кислоты представляют собой жидкости или твердые вещества. Водные растворы кислот изменяют цвет индикаторов:
- лакмус: фиолетовый → красный;
- метилоранж: оранжевый → красный;
- универсальный: оранжевый → красный;
Фенолфталеин на кислую среду не реагирует.
Химические свойства
- Реакции замещения с металлами, расположенными в электрохимическом ряду активности до водорода:
Водород не выделяется в реакциях с концентрированной серной и азотной кислотами, так как металлы в этом случае окисляются серой S6+ и азотом N5+:
- Реакции обмена с различными классами соединений:
- С основными и амфотерными оксидами:
Продукты реакции – соль и вода.
- С основаниями в реакциях нейтрализации с образованием соли и воды:
- С солями, если происходит выпадение осадка или выделение газа:
Сильная кислота вытесняет из соли более слабую. Сила кислот убывает слева направо в ряду:
Так, в карбонате кальция CaCO3 плавиковой кислотой HF вытесняется угольная H2CO3:
- Разложение
При нагревании молекулы нерастворимых кислот разлагаются на кислотный оксид и воду:
Неустойчивые молекулы угольной и сернистой кислот разлагаются в момент образования на газ и воду:
Получение
Кислоты образуются при взаимодействиях:
Применение
Кислоты применяются во множестве отраслей: в пищевой, легкой, химической промышленности, в производстве медицинских препаратов, в горном деле.
Из минеральных кислот наиболее широко используются серная, азотная, ортофосфорная, соляная. Карбоновые кислоты – щавелевая, уксусная, масляная, муравьиная и другие – также находят применение в различных областях: от производства продуктов питания до металлургии.
Это интересно:
Задания
1. Назовите валентность кислотного остатка:
-
- H3SbO4;
- H4SnO4;
- H2Te;
- HBrO4.
2. Установите степени окисления элементов в кислотах и наименования кислот в соответствии с номенклатурой:
-
- H3AsO4 и HAsO3;
- HIO2 и HIO3.
3. Какое соединение в ряду CO2, BaSO4, HCl, HCOOH, Na2CO3, H2SiO3, MgO, H3AsO4 является:
-
- двухосновной кислотой;
- трехосновной кислотой;
- сильной кислотой;
- карбоновой кислотой?
4. Определите тип реакции Mg+HCl=? Каковы ее продукты? Составьте ее молекулярное и ионное уравнения.
5. H2WO4 – малорастворимая вольфрамовая кислота. На какие вещества она разлагается при нагревании? Составьте уравнение реакции разложения.