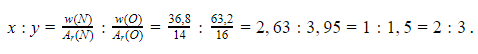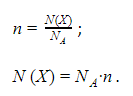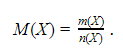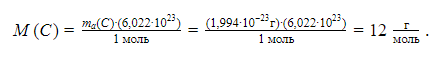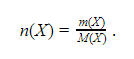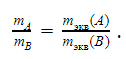Содержание
При расчетах химических процессов необходимо оперировать массами веществ в абсолютных и относительных единицах. Эти величины требуется поставить в соответствие с числом частиц, участвующих во взаимодействиях. Выразив через количество вещества это множество объектов микромира, химики получили возможность быстро, без громоздких вычислений решать задачи, связанные с соотношением веществ.
Размеры и масса структурных единиц вещества
Вещество строится из микроскопических частиц – атомов и молекул. Атом – это носитель индивидуальных свойств химического элемента, наименьшая частица, способная вступать в химическое взаимодействие. Молекула – устойчивое сочетание атомов – является минимальной порцией вещества, которой присущи его химические свойства.
У атома нет четкой границы. Его радиус определяется по правилам квантовой механики и зависит от заряда ядра. Величины атомных радиусов лежат в диапазоне от 3,1∙10-11 м у гелия до 2,9∙10-10 м у франция. Характерный размер большинства атомов – 10-10 м. Размеры молекул сопоставимы с атомными.
Массы атомов сильно различаются. Легчайший атом с массой 1,67∙10-27 кг принадлежит водороду. Атом урана-238 имеет массу 3,95∙10-25 кг. Массу молекулы определяют сложением масс составляющих ее атомов.

Относительные массовые величины
Вести расчеты в абсолютных значениях масс атомов и молекул неудобно из-за их малости. Химики используют безразмерные величины, выражающие отношение массы частицы вещества к эталону – атомной единице массы (а. е. м.), в качестве которой выбрана 1/12 массы атома углерода.
где u – атомная единица массы; ma(C) – масса атома углерода.
- Относительная атомная масса показывает, во сколько раз атом химического элемента массивнее эталона:
Для кислорода она составляет ![]() для водорода
для водорода ![]() . Относительные атомные массы элементов указаны в периодической таблице Д. И. Менделеева. Их округляют до целых чисел, за исключением атомной массы хлора (35,5).
. Относительные атомные массы элементов указаны в периодической таблице Д. И. Менделеева. Их округляют до целых чисел, за исключением атомной массы хлора (35,5).
- Относительная молекулярная масса – это отношение массы молекулы вещества к а. е. м.:
Эта величина есть сумма относительных масс атомов, образующих молекулу. Так, для сероводорода она равна Mr (H2S)=2∙Ar (H)+Ar (S)=2∙1+32=34.
- Относительная формульная масса – характеристика веществ, имеющих немолекулярное строение. Это сумма относительных атомных масс химических элементов, образующих формульную единицу, с учетом индексов. Например, формульная масса поваренной соли Mr (NaCl)=Ar (Na)+Ar (Cl)=23+35,5=58,5.
Массовая доля
Из формулы соединения можно получить массовые доли входящих в его состав элементов:
где w(A) – массовая доля элемента A; x, y – индексы элементов A и B.
Пример: расчет массовых долей натрия и кислорода в оксиде натрия Na2O.
Проверка: 26+74=100%.
Формулу химического соединения можно установить по массовым долям. Пусть в соединении азота и кислорода NxOy на долю азота приходится 36,8% массы. Тогда массовая доля кислорода будет:100-36,8=63,2%. Далее вычисляется соотношение индексов x и y:
Следовательно, формула вещества – N2O3.
Химическое количество вещества
В качестве единицы измерения химического количества вещества в международной системе СИ принят моль – порция вещества, содержащая приблизительно ![]() структурных частиц. Столько атомов насчитывается в 0,012 кг углерода. Независимо от агрегатного состояния 1 моль любого вещества содержит
структурных частиц. Столько атомов насчитывается в 0,012 кг углерода. Независимо от агрегатного состояния 1 моль любого вещества содержит ![]() молекул или формульных единиц.
молекул или формульных единиц.
Постоянная Авогадро
Величину ![]() , установленную в экспериментах, называют постоянной Авогадро и обозначают символом NA. Эта константа устанавливает масштаб соотношений, показывающих, как найти количество вещества n из числа атомов или молекул в веществе N(X), или произвести обратные вычисления:
, установленную в экспериментах, называют постоянной Авогадро и обозначают символом NA. Эта константа устанавливает масштаб соотношений, показывающих, как найти количество вещества n из числа атомов или молекул в веществе N(X), или произвести обратные вычисления:
Например, число молекул в 2 молях азотной кислоты составит ![]()
Молярная масса
Существует величина, выражающая массу одного моля вещества, – молярная масса. Она равна отношению массы к количеству вещества и имеет размерность кг/моль или, чаще, г/моль:
Молярная масса элемента равна массе ![]() его атомов. В единицах г/моль она численно совпадает с величиной относительной атомной массы и для углерода равна:
его атомов. В единицах г/моль она численно совпадает с величиной относительной атомной массы и для углерода равна:
Молярные массы соединений вычисляют путем сложения:
Молярная масса воды составляет ![]() 1 моль молекул воды содержит 2 моля атомов водорода и 1 моль атомов кислорода.
1 моль молекул воды содержит 2 моля атомов водорода и 1 моль атомов кислорода.
По молярной массе можно найти, сколько молей составляет количество вещества некоторой массы:
Например, 280 г оксида кальция соответствует количество ![]()
Эквивалентная масса
Количество вещества, реагирующее с 1 молем ионов водорода, называется эквивалентом, а его масса mэкв – эквивалентной. Она рассчитывается из молярной массы и зависит от того, к какому классу соединений принадлежит вещество.
С помощью этой величины описывают химические взаимодействия, опираясь на закон эквивалентов: отношение масс реагентов (и продуктов реакции) пропорционально отношению их эквивалентных масс:
Это упрощает расчеты, позволяя обойтись без составления уравнения реакции.
Задачи
Задача 1. Определите относительные молекулярные массы:
- фосфорной кислоты H3PO4;
- нитрата кальция Ca(NO3)2.
Задача 2. Определите массовые доли химических элементов:
- в сульфате калия K2SO4;
- в оксиде алюминия Al2O3.
Задача 3. Определите формулу:
- соединения водорода и фтора с массовой долей водорода 5%;
- соединения углерода, кальция и кислорода с массовыми долями кислорода и углерода соответственно 48% и 12%.
Задача 4. Определите химическое количество вещества:
- в 31 г фосфора;
- в 240 г оксида магния.
Задача 5. Определите число молекул:
- в 360 г воды;
- в 80 г брома.
Задача 6. Определите массу:
- серной кислоты химическим количеством 0,25 моль;
- хлорида цинка химическим количеством 2,5 моль.