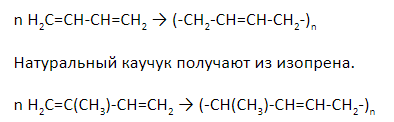Содержание
- 1 Строение молекул и классификация диенов
- 2 Изомерия алкадиенов с сопряженной связью
- 3 Гомологи диенов и их номенклатура
- 4 Классификация диенов
- 5 Особенности сопряженных диенов
- 6 Физические свойства алкадиенов
- 7 Получение алкадиенов
- 8 Химические свойства алкадиенов
- 9 Реакция Дильса-Альдера
- 10 Полимеризация диенов
- 11 Применение алкадиенов
Углеводороды гомологического ряда диенов, или алкадиенов, отличаются высокой химической активностью, обусловленной особенностями строения молекул. Алкадиенам присуще разнообразие строения, поэтому в гомологическом ряду существует внутренняя классификация. Свойства алкадиенов, принадлежащих к разным типам, заметно отличаются.
Строение молекул и классификация диенов
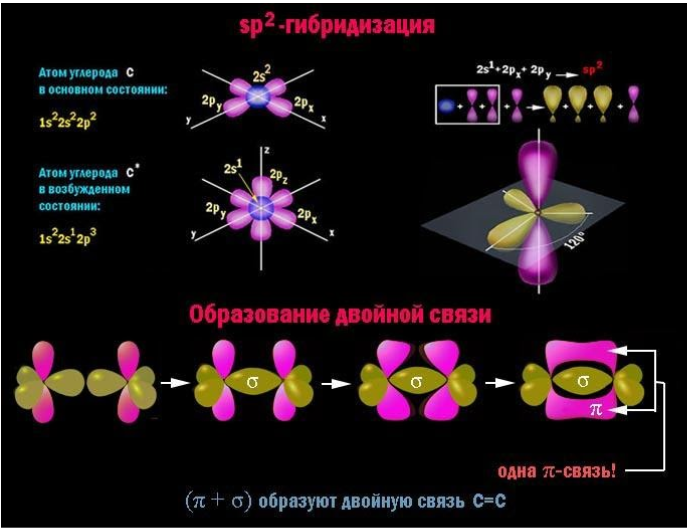
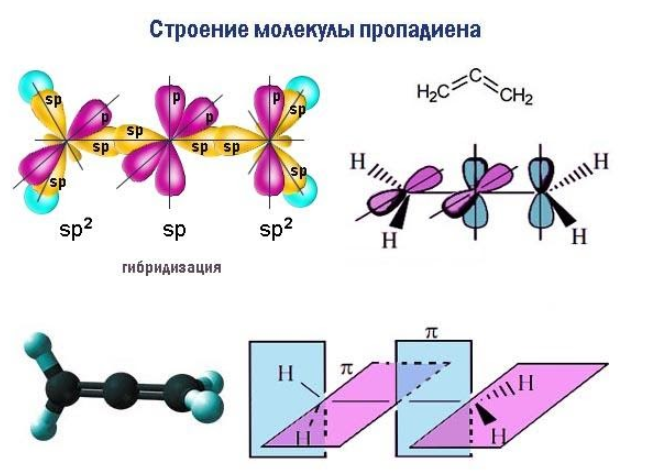
Главный признак алкадиенов – две двойные связи в углеродном скелете. Молекула содержит две пары атомов углерода с sp2-гибридизованными внешними электронными облаками. Для данного состояния атома характерно наличие одной негибридной p-орбитали, располагающейся перпендикулярно плоскости, проходящей через центры взаимодействующих атомов.
В каждой паре таких атомов помимо прочно соединяющей их по кратчайшему расстоянию σ-связи, за счет перекрывающихся p-облаков возникает менее устойчивая π-связь. Сочетание (σ+π) и есть двойная связь C=C. При внешнем воздействии ее π-компонент легче поддается разрыву и освобождает у пары углеродных атомов по одной валентности для химического взаимодействия.
Поскольку у диеновых углеводородов на формирование двойных связей затрачивается по две валентности для каждой углеродной пары, до полного насыщения молекуле не хватает четырех водородных атомов. Химическая формула алкадиенов имеет вид ![]() .
.
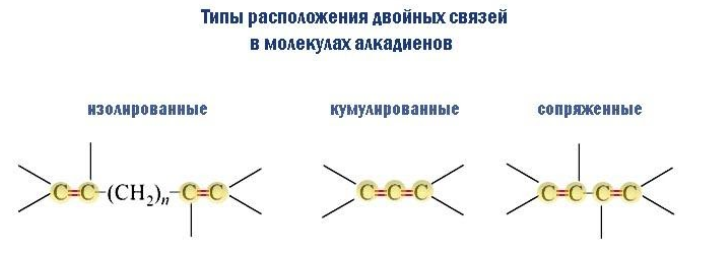
Типология диенов по взаимному положению двойных связей
Различают три типа расположения, при которых различаются степень и характер влияния связей C=C друг на друга:
- Изолированные связи разделены двумя и более простыми связями C–C. По химическим свойствам такие соединения аналогичны алкенам, так как связи C=C не взаимодействуют между собой. Пример – гексадиен-1,4: CH2=CH–CH2–CH=CH–CH3.
- Кумулированные (алленовые) связи формируются тремя находящимися рядом углеродными атомами, как в молекуле пропадиена (аллена): CH2=C=CH2. Здесь плоскости, в которых функционируют -связи, взаимно перпендикулярны, что влечет за собой неустойчивость алленовой системы.
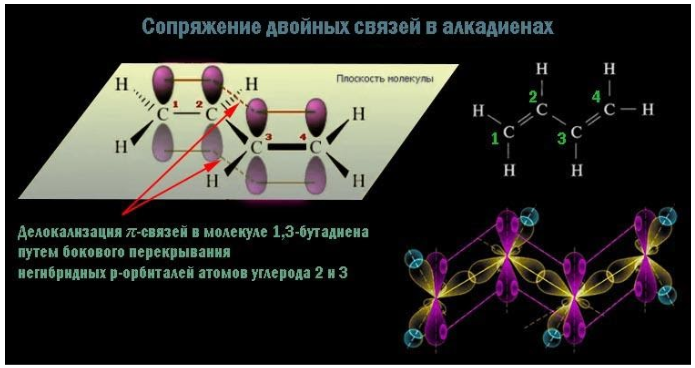
- Сопряженные системы возникают, когда связи C=C и C–C чередуются. В этом случае благодаря одинаковой ориентации осей всех перекрывающихся p-облаков их электроны образуют единую систему с равномерно распределенной плотностью, что приводит к укорочению
 -связи и стабилизации молекулы.
-связи и стабилизации молекулы.
Соединения этого типа представляют наибольший интерес в плане практического использования.
Изомерия алкадиенов с сопряженной связью
Диены образуют как структурные, так и пространственные изомеры.
Структурная изомерия
Диеновые молекулы могут различаться по следующим признакам:
- Позиция сопряженной связи:
гексадиен-1,3 гексадиен-2,4 .
- Строение углеродного скелета:
- наличие соединений других классов, имеющих тот же атомный состав, – межклассовых изомеров. К их числу относятся алкины и циклоалкены.
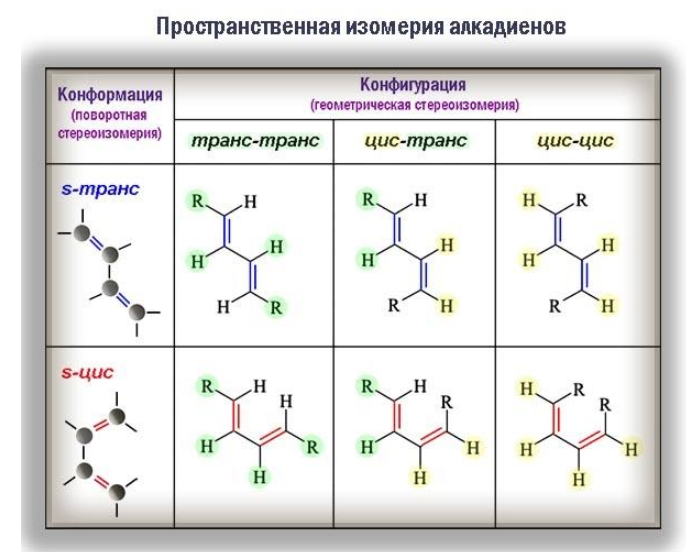
Пространственная изомерия
Стереоизомерия (геометрические различия) возникает вследствие того, что фрагменты молекулы не могут вращаться вокруг кратной связи. Одинаковые заместители при этом оказываются либо по одну сторону от плоскости π-связи (цис-изомеры), либо по разные (транс-изомеры) и оказать влияние на реакционную способность.
Большое значение имеет и конформация молекул. Так, при вращении молекулы вокруг -связи, объединяющей сопряженную систему –C=C–C=C–, возникают поворотные (конформационные) изомеры:
- цисоиды, или заслоненные конформеры, в которых радикалы одного типа в торцевой проекции налагаются друг на друга;
- трансоиды, или заторможенные конформеры, одинаковые радикалы которых разведены на максимальное расстояние.
В то время как геометрическая изомерия связана с неизменной конфигурацией углеводородной молекулы, поворотные изомеры способны переходить из одного состояния в другое.
В трансоидной конформации молекула диена обладает минимальной энергией и вследствие этого менее реакционноспособна. Определенные химические превращения, например реакции диенового синтеза, протекают избирательно только с участием s-цис-конформера.
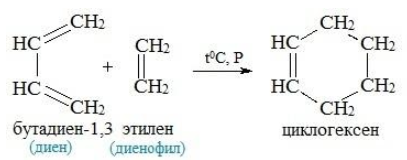
Реакция Дильса-Адлера бутадиен-1,3 этен циклогексен дивинил этилен .
Гомологи диенов и их номенклатура
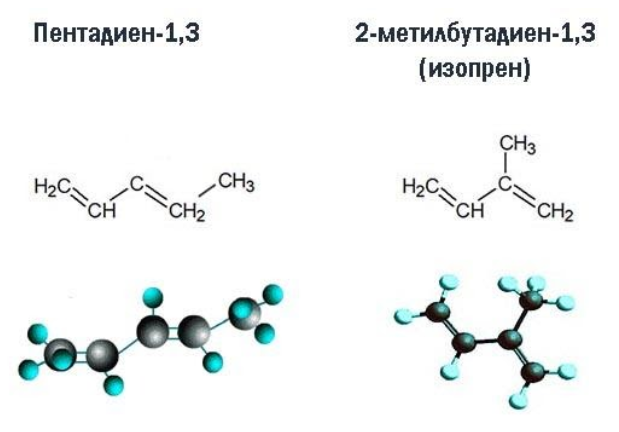
Поскольку в формуле алкадиенов две кратные связи, гомологический ряд должен начинаться с соединения, в котором три углеродных атома. Название соединения образуется из корня, суффикса –диен– и номеров атомов с кратными связями. Например, H2C=CH-CH2-CH=CH-CH2-CH2-CH3 – октадиен-1,4.
Гомологи алкадиенов приведены в таблице ниже:
| Формула | Наименование |
| C3H4 | пропадиен |
| C4H6 | бутадиен |
| C5H8 | пентадиен |
| C6H10 | гексадиен |
| C7H12 | гептадиен |
| C8H14 | октадиен |
| C9H16 | нонадиен |
Классификация диенов
Кратные связи в диенах могут стоять в разных местах. Алкадиены бывают:
- кумулированные (аллены) – молекулы, кратные связи которых располагаются при одном углеродном атоме (H2C=C=CH2);
- сопряженные – молекулы, кратные связи которых находятся на расстоянии одинарной (H2C=CH-CH=CH2);
- изолированные – молекулы, кратные связи которых отделены двумя и более одинарными (H2C=CH-CH2-CH2-CH2-CH2-CH=CH2).
Особенности сопряженных диенов
Сопряженные диены имеют атомы углерода в sp2-гибридизации. π – электроны создают единую систему и располагаются равномерно по всей молекуле. Все атомы образуют p-облако. Такой тип называется π,π-сопряжение.
Настоящее строение таких алкадиенов отражает наличие делокализованных «полуторных» связей.
Физические свойства алкадиенов
В нормальных условиях алкадиены схожи с алкенами. Первые два представителя гомологического ряда диеновых углеводородов – газы, не имеющие цвет, но со специфическим запахом. Алкадиены, имеющие до семнадцати углеродных атомов в цепи, — жидкости. Диены, находящиеся ниже по гомологическому ряду, – твердые вещества. Температуры плавления и кипения поднимаются по мере роста молекулярной массы.
Это интересно:
Получение алкадиенов
Существует несколько способов получения диенов.
Дегидрирование алканов
В промышленных условиях бутадиен-1,3 получают из 2-метилбутана под действием катализатора Al2O3 и повышенных температур.
Синтез Лебедева
Бутадиен-1,3 также получают из этанола под действием катализаторов Al2O3, ZnO и повышенных температур.
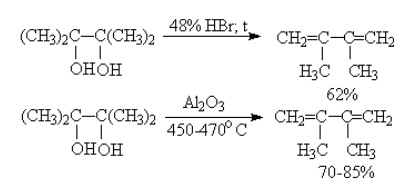
Дегидратация двухатомных спиртов
Реакция проходит под действием бромоводорода HBr (выход диенов – 62%) или оксида алюминия Al2O3 (выход диенов – 70-85 %).
Дегидрогалогенирование дигалогеналканов
Отщепление подчиняется правилу Зайцева и идет под действием спирта.
Химические свойства алкадиенов
Свойства алкадиенов обуславливают возможность вступления в реакции присоединения. Кратная связь увеличивает реакционную способность и обуславливает необычные механизмы некоторых реакций.
Реакция Дильса-Альдера
Эта реакция заключается во взаимодействии диенов и диенофилов с образованием шестичленных гидроароматических колец. Реакция обратима и проходит при нормальных условиях или слабом нагревании.
Полимеризация диенов
Полимеризация – это реакция последовательного соединения мономеров с целью получения полимера. У алкадиенов полимеризация протекает по 1,4-механизму.
Синтетический каучук получают из дивинила.
Применение алкадиенов
Диены – это ненасыщенные алифатические соединения с двумя двойными связями. Особенности строения алкадиенов указывают на то, что им доступны лишь реакции присоединения. У сопряженных диенов есть единое π – облако, которое позволяет вступать в различные реакции. Алкадиены имеют большое промышленное значение.
Диенами часто используются в промышленности при получении каучуков. Их них изготавливают автомобильные и велосипедные шины.
Органические соединения, имеющие две и более двойные связи, — терпены. Они есть в составе организма, а также их синтезируют и применяют в производстве парфюма.