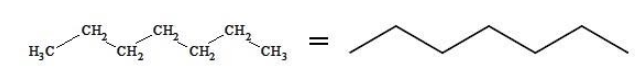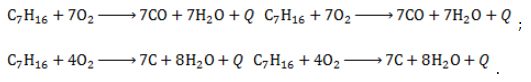Содержание
Гептан – седьмой член гомологического ряда алканов. Вследствие различий в порядке соединения и пространственного расположения атомов в молекуле гептан образует несколько изомеров, проявляющих разные свойства. Источником получения гептана служат нефть и нефтепродукты, попутный и природный газ.
Химическое строение и формула гептана
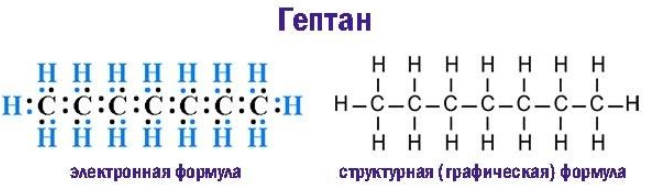
Предельные углеводороды, к числу которых относится гептан, характеризуются полным насыщением всех валентностей углерода. Располагая каждый четырьмя свободными валентностями, sp3-гибридизованные углеродные атомы в молекулах алканов образуют насыщенные водородом цепочки состава ![]() .Молекула гептана, скелет которой составлен семью атомами углерода, описывается химической формулой С7H16.
.Молекула гептана, скелет которой составлен семью атомами углерода, описывается химической формулой С7H16.
Каждая общая электронная пара, возникающая при взаимодействии атомов, соответствует одинарной (простой) ковалентной ![]() -связи. Строение молекулы графически выражают электронная и структурная формулы:
-связи. Строение молекулы графически выражают электронная и структурная формулы:
Скелетная формула представляет строение гептана в компактном виде как зигзагообразную линию. Атомы, формирующие углеродный скелет, находятся в вершинах и на концах линии; при записи их обозначения обычно опускают:
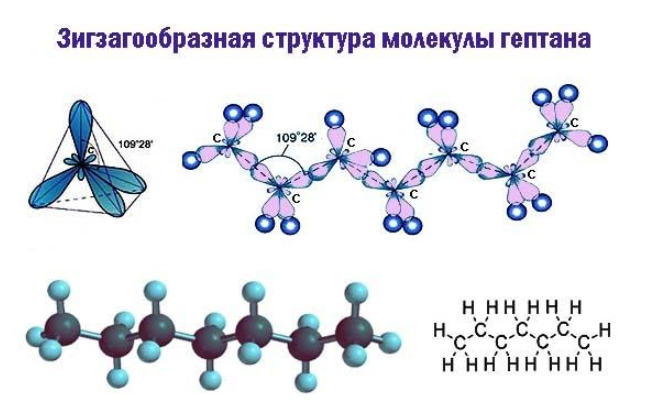
В двумерной форме зигзаг более точно показывает строение молекулы, так как ориентация связей C-C соответствует углу ![]() , который образуется между валентными орбиталями при sp3-гибридизации.
, который образуется между валентными орбиталями при sp3-гибридизации.
Изомеры гептана
Благодаря возможности ветвления углеродного скелета и пространственным различиям в положении одинаковых алкильных радикалов соединениям состава свойственна изомерия. Всего у гептана насчитывается 11 изомерных вариантов.
Структурная изомерия
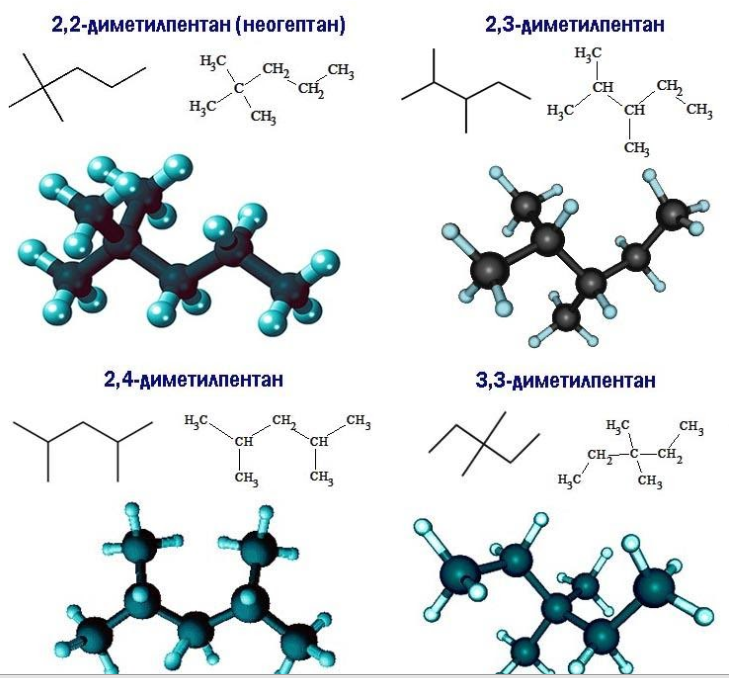
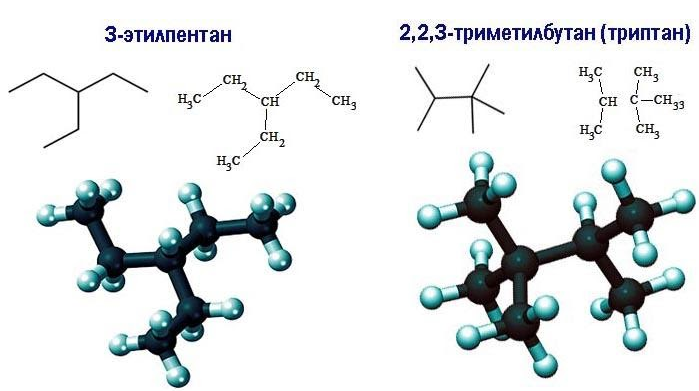
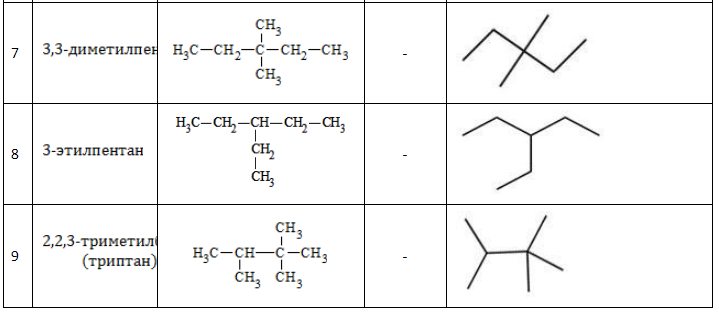
Существует девять изомеров с химической формулой C7H16, различающихся строением молекулы. По длине главной углеродной цепочки, по типу и числу радикалов они подразделяются следующим образом:
Оптическая изомерия
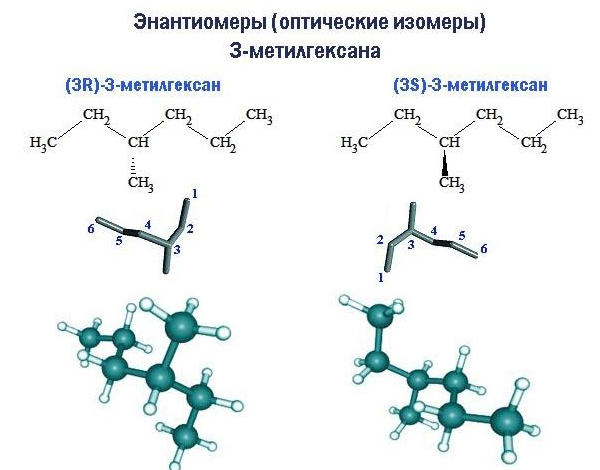
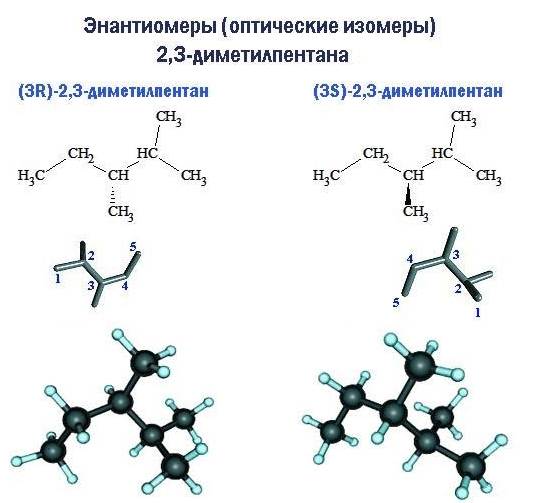
Если при одинаковой структуре молекулы расположение радикалов таково, что молекула не имеет зеркальной симметрии, возникает пространственная изомерия оптического типа.
Молекулы оптических изомеров (иначе называемых энантиомерами) обладают свойством хиральности: зеркально отображая друг друга, они при вращении не становятся идентичными. Примером хиральности является отличие правой ладони от левой. Центром хиральности молекулы является тот атом углерода, к которому у энантиомеров присоединены радикалы, по-разному ориентированные в пространстве.
Хиральность свойственна двум из девяти структурных изомеров гептана. Каждое из этих соединений – 3-метилгексан и 2,3-диметилпентан – существует в форме двух энантиомеров, обозначаемых как правый (R) и левый (S) изомеры. При этом указывается номер центра хиральности в углеродной цепи.
В среде с оптической активностью или в химической реакции с другим хиральным соединением энантиомеры ведут себя различно. В других случаях их свойства одинаковы.
Список изомеров
Все изомеры гептана с названиями и формулами, с учетом наличия энантиомеров, перечислены в таблице:
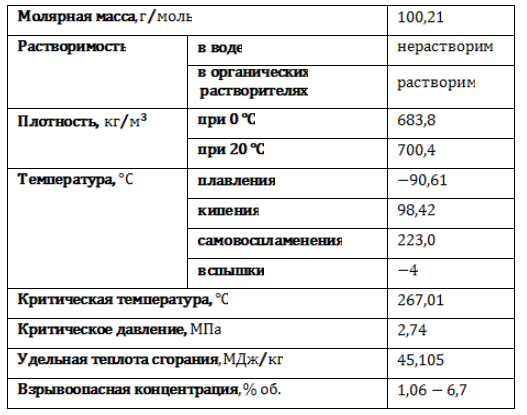
Физические свойства
Гептан в обычных условиях представляет собой легкую подвижную жидкость с резким специфическим запахом, без цвета. Пары гептана тяжелее воздуха и образуют с ним взрывоопасную смесь. Основные физические свойства н-гептана приведены в таблице:
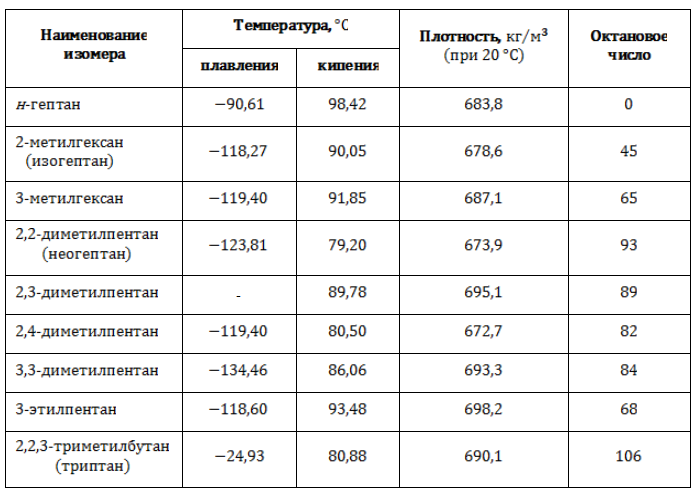
Свойства изомеров гептана
Различия в строении молекулы являются причиной неодинаковости плотностных и термических характеристик изомеров, в том числе и такой важной, как детонационные свойства.
Устойчивость горючего к взрыву при сжатии выражают через октановое число, сравнивая топливо с эталоном. В состав эталонной смеси входят н-гептан, который крайне склонен к детонации, и чрезвычайно устойчивый к ней изооктан. Процентное содержание изооктана в эталонной смеси называется октановым числом.
Существует зависимость между степенью разветвленности молекулы и стойкостью углеводорода к детонации. Чем больше алкильных радикалов и, соответственно, третичных и четвертичных углеродных атомов содержит молекула, тем выше антидетонационная характеристика и качество топлива.
Химические свойства
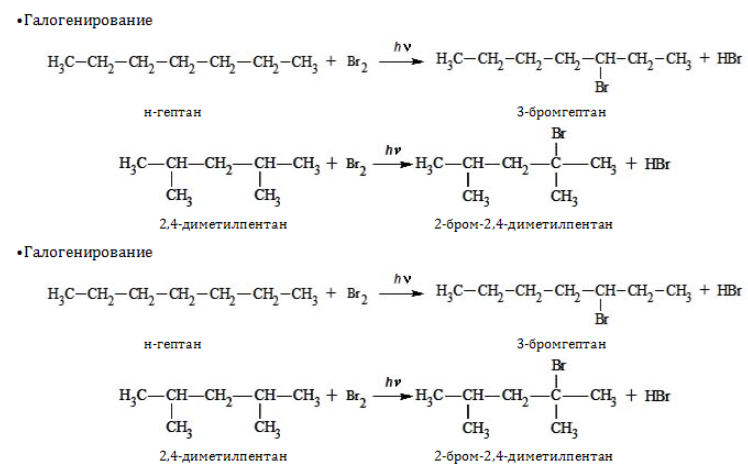
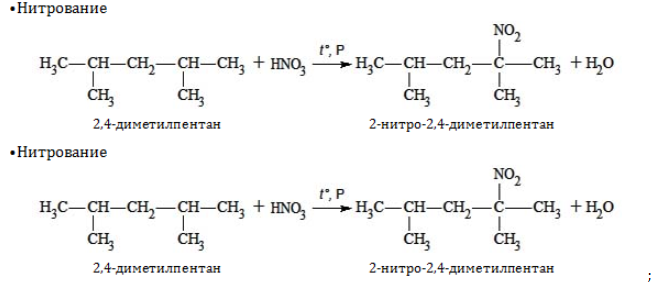
Гептан и его изомеры – предельные углеводороды и проявляют все химические свойства, присущие данному классу органических соединений. Вследствие насыщенного характера всех связей они вступают только в реакции, протекающие с разрывом ковалентной связи. При этом, как правило, необходимо подвергнуть реагенты нагреванию и использовать катализаторы.
1. Замещение:
2. Окисление:
При недостатке кислорода продуктами неполного сгорания гептана являются угарный газ и сажа:
3. Разложение на низшие алканы и алкены при нагревании без доступа кислорода (крекинг):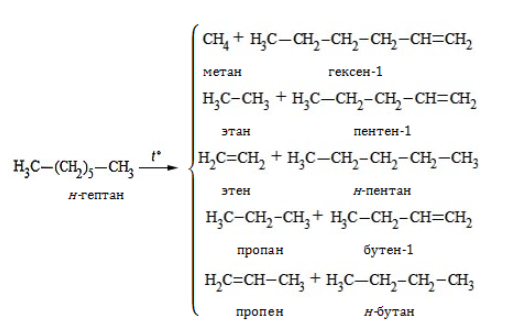
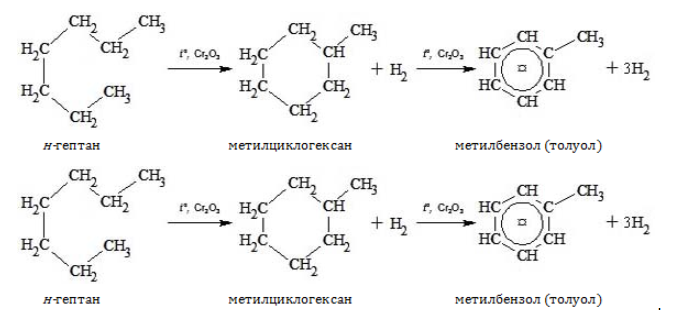
4. Дегидрирование с образованием циклического углеводорода (дегидроциклизация):
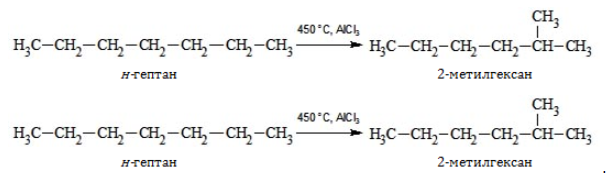
5. Изомеризация с ветвлением углеродного скелета:
Получение гептана и его изомеров
Промышленное получение соединений с химическим составом С7H16 проводится при добыче и переработке природного газа и нефти либо методом синтеза Фишера–Тропша наряду с прочими углеводородами:
В лабораторной практике гептан и изомеры синтезируются следующими способами:
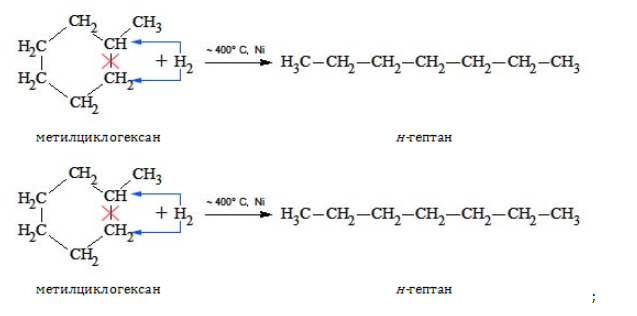
- гидрирование и дециклизация циклоалканов:
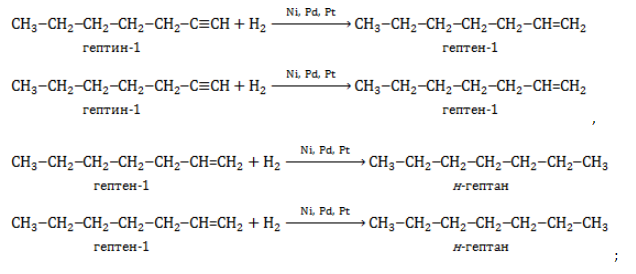
- гидрирование алкинов и алкенов:
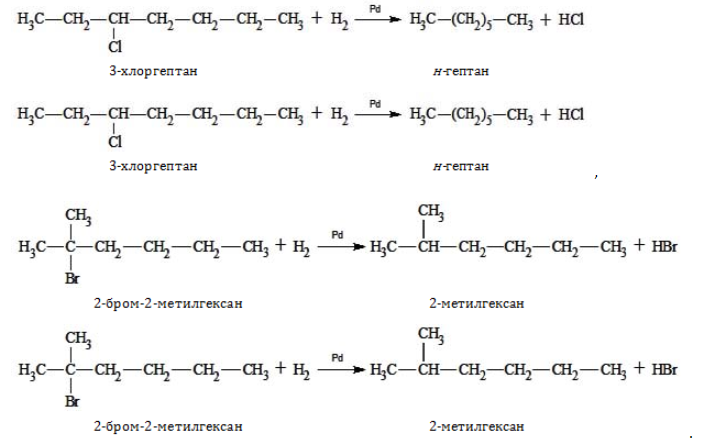
- восстановление галогенпроизводных предельных углеводородов:
Применение гептана и его изомеров
Углеводороды состава C7H16 используются в различных отраслях в зависимости от свойств.
1. В топливной промышленности находят применение:
- н-гептан – в качестве компонента эталонной смеси для определения антидетонационных качеств горючего;
- 2,2,3-триметилбутан (триптан) повышает устойчивость к детонации и добавляется в бензин как присадка.
2. В нефтепереработке и химической промышленности:
- н-гептан играет важную роль в процессах циклизации и ароматизации углеводородов, например, при получении толуола.
3. В качестве растворителя (чистый н-гептан либо в смеси с изомерами):
- для обработки склеиваемых поверхностей в производстве различных изделий из пластических масс;
- в технологиях экстрагирования растительных масел.
Это интересно:
Заключение
В отношении пожаро- и взрывоопасности гептан входит в число опасных грузов III класса (легковоспламеняющиеся жидкости). Гептан оказывает раздражающее воздействие на центральную нервную систему и по шкале токсикологической опасности относится к веществам IV класса. При длительной работе с ним необходимо защищать кожные покровы и органы дыхания.
При использовании защитных средств, соблюдении герметичности тары и оборудования, вентиляции помещений работа с гептаном не представляет угрозы. Большим преимуществом гептана, как и прочих жидких углеводородов, является удобство хранения и транспортировки по сравнению с газообразными низшими алканами.