Содержание
Октан – восьмой член в гомологическом ряду алканов. Изомеры октана характеризуются структурным разнообразием, вследствие чего свойства этих веществ различны. Они, в свою очередь, определяют сферу применения того или иного изомера. Главным источником для получения октанов служит нефть и продукты ее переработки.
Формула и строение
Являясь типичными предельными углеводородами ациклического строения, октаны содержат наибольшее возможное количество атомов водорода. Построение углеродного скелета и удержание на нем водородных атомов осуществляется только за счет прочных одинарных ![]() -связей.
-связей.
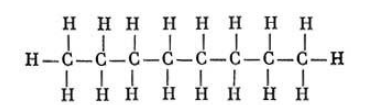
Состав октана выражается химической формулой С8H18. Простейшее строение молекулы октана представляет собой неразветвленную и не содержащую циклов цепь, так называемый нормальный, или н-октан. Она образована восемью углеродными атомами, валентности которых полностью насыщены.
Структурная формула октана:
Строение молекулы можно также изобразить с помощью скелетной формулы, где символы водорода и углерода опускаются. Вершины и концы ломаной линии означают углеродные атомы:
Зигзагообразная форма линии точнее отражает молекулярную структуру углеводородов, так как углеродные атомы связываются между собой не линейно, а подчиняясь валентным углам, возникающим у атома в sp3-гибридизованном состоянии.
Поскольку вокруг ![]() -связей возможно вращение, молекула может образовывать ряд конформаций – вариантов расположения атомов по отношению друг к другу. Для линейных алканов наиболее энергетически выгодной и стабильной является конформация в виде зигзага.
-связей возможно вращение, молекула может образовывать ряд конформаций – вариантов расположения атомов по отношению друг к другу. Для линейных алканов наиболее энергетически выгодной и стабильной является конформация в виде зигзага.
Изомерия октана
У соединений состава С8H18 изомеры возникают не только вследствие вариантов ветвления цепочки. Октаны способны образовывать изомеры на основе оптических различий между структурно одинаковыми молекулами. Все изомеры октана являются насыщенными ациклическими углеводородами – кратные связи в них не появляются.
Структурная изомерия
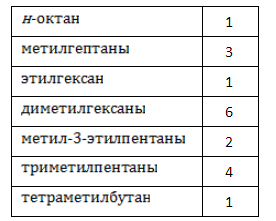
Алканы образуют структурные изомеры лишь по одному признаку – по порядку связывания атомов, формирующих углеродный скелет. Таких изомеров насчитывается 18, и их удобно разделить на группы по типу и количеству алкильных радикалов:
Оптическая изомерия
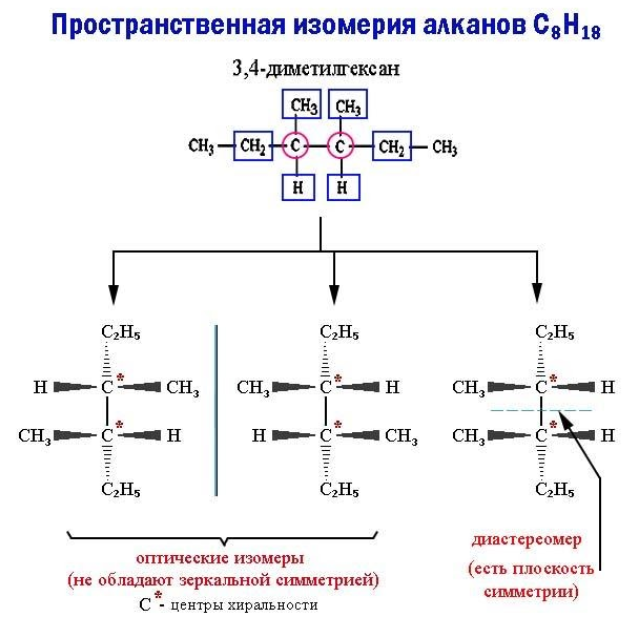
Пространственные изомеры данного типа, называемые также энантиомерами, при идентичной структуре не обладают зеркальной симметрией. Такие молекулы-энантиомеры представляют собой взаимные зеркальные отражения, которые не могут совпасть при вращении, – антиподы. Отсутствие зеркальной симметрии носит название хиральности (пример – правая и левая руки).
Хиральность возникает, если все четыре заместителя при каком-либо углеродном атоме оказываются разными. В этом случае в молекуле отсутствует плоскость симметрии. Как бы ни вращался этот атом (центр хиральности) вместе с радикалами, молекулу невозможно совместить с ее зеркальным отражением.
Если же молекула обладает плоскостью симметрии, она не является оптическим изомером. Возникает другой тип пространственной изомерии – диастереомерия.
Энантиомеры проявляют свои различия только в оптически активной среде. Так, являясь антиподами, они поворачивают в противоположных направлениях плоскость поляризации света. В химических взаимодействиях с хиральными соединениями (например, аминокислотами) оптические изомеры существенно различаются по реакционной способности.
Наименования и формулы изомеров октана



Физические свойства
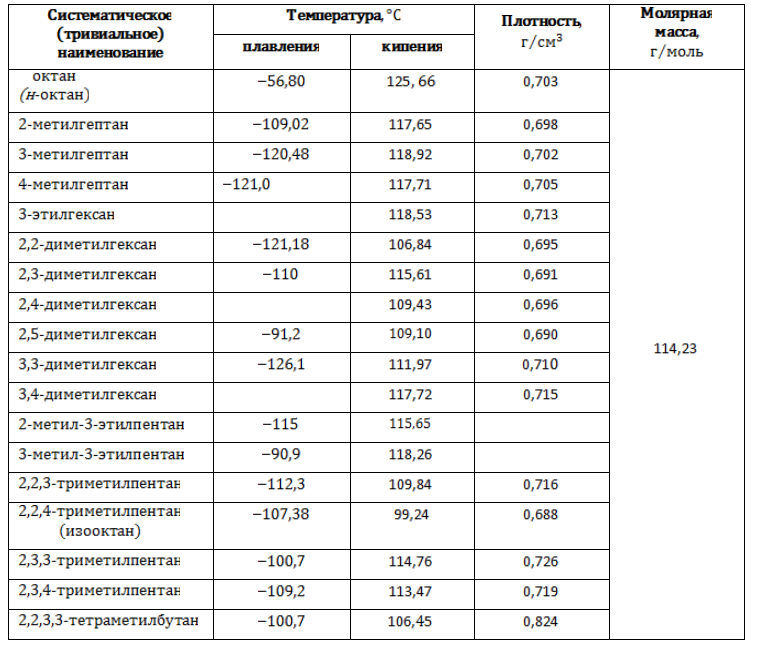
Октаны – прозрачные жидкости без цвета, со слабо выраженным запахом. Появление боковых ветвей в молекулах изомерных форм прежде всего влияет на межмолекулярные связи, что приводит к изменению температур, при которых вещества совершают фазовые переходы.
Изомеры состава С8H18, подобно всем алканам, нерастворимы в воде, но растворяются в эфирах, бензоле и других органических растворителях.
Основные физические характеристики октанов приводятся в таблице.
Химические свойства
Изомерные октаны принадлежат к одному классу веществ – насыщенным ациклическим углеводородам. Поэтому в химических взаимодействиях они проявляют типичные для алканов свойства:
- не участвуют в реакциях присоединения;
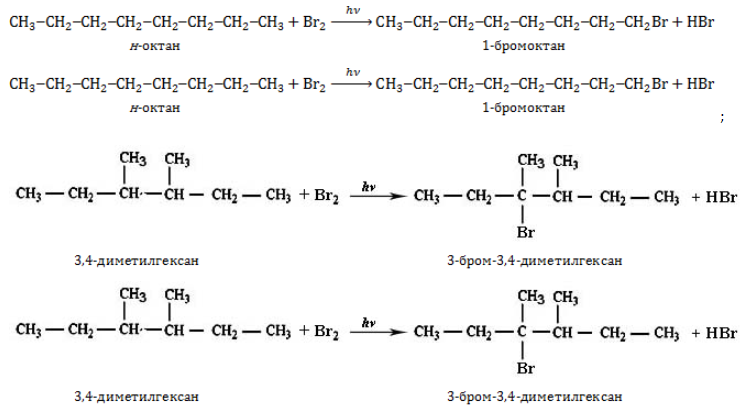
- вступают в реакции замещения:
- при комнатной температуре устойчивы к действию окислителей;
- отличаются горючестью:
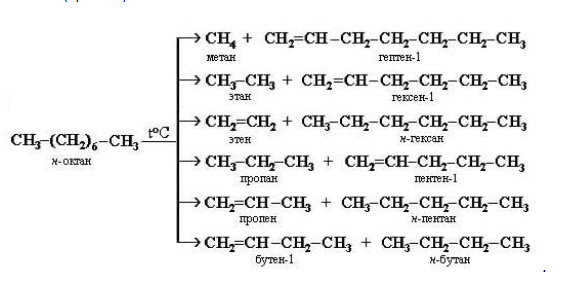
- разлагаются при температурах свыше 500 С без доступа воздуха на смесь низших алканов и алкенов (крекинг):
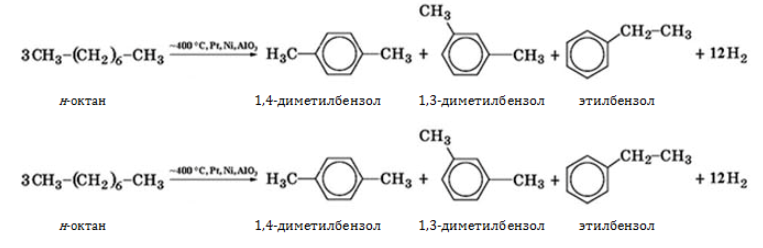
- дегидрируются при температуре
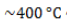 на катализаторе с образованием циклоалкана и последующим превращением в ароматический углеводород бензольного ряда:
на катализаторе с образованием циклоалкана и последующим превращением в ароматический углеводород бензольного ряда:
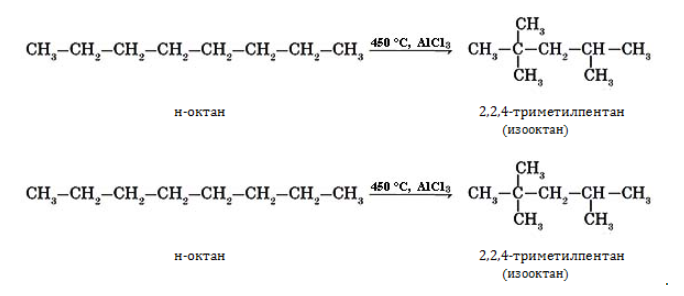
- изомеризуются с образованием разветвленной молекулы:
Получение октанов
Для лабораторного синтеза октана и его изомеров применяются следующие методы:
- гидрирование ненасыщенных линейных углеводородов – алкенов и алкинов:
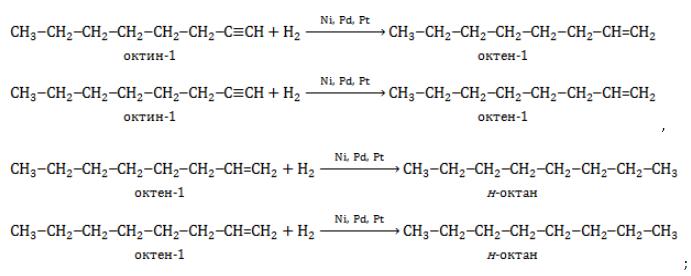
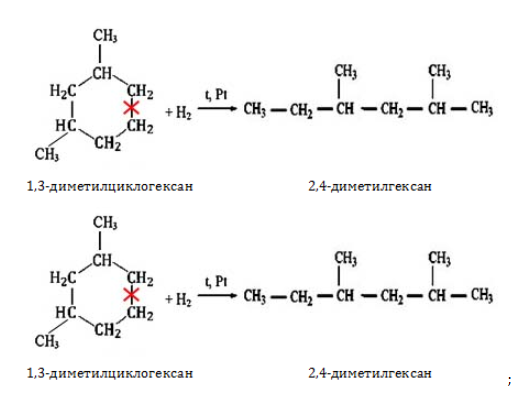
- гидрирование циклоалканов:
- восстановление галогеналканов:
- синтез низших галогеналканов с участием металлического натрия, отнимающего галоген (реакция Вюрца):
В промышленности октан и его изомеры получают в процессах бензиновой фракции нефти или в числе прочих углеводородов при синтезе по методу Фишера–Тропша:
Применение октанов
Как сырье или промежуточный продукт октан используется в органическом синтезе. С его помощью получают ароматические углеводороды бензольного ряда – этилбензол и ортоксилол – а также другие соединения. Октан также применяется в качестве растворителя. Как компонент топлива октан играет скорее отрицательную роль, так как понижает устойчивость горючего к детонации.
Изооктан благодаря разветвленной структуре молекулы не склонен к детонации, вследствие чего принят в качестве эталона для определения качества бензина. Изооктан входит в состав авиационного топлива. Как химическое сырье изооктан не находит применения. Сфера его использования ограничена топливной отраслью, в которой изооктан играет важную роль.
Это интересно:



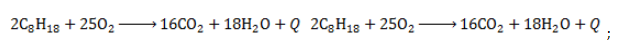






 (голосов: 2, средняя оценка: 3,50 из 5)
(голосов: 2, средняя оценка: 3,50 из 5)