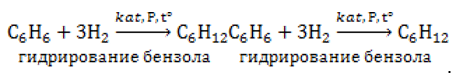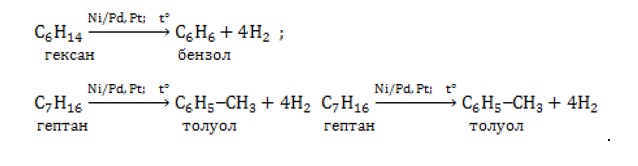Содержание
Основой химии органических веществ являются углеводороды – соединения, в составе которых присутствуют только углерод и водород. По строению различают ациклические и циклические углеводороды, разница между которыми определяется наличием замкнутых участков в составе углеродной цепочки. Эти участки – кольца, или циклы – оказывают влияние на свойства соединения.
Общее представление о циклических углеводородах. Циклоалканы
Содержащие в молекуле как минимум одно кольцо углеводороды называют также карбоциклическими соединениями. Образование цикла происходит за счет возникновения химической связи между концевыми атомами углерода линейной молекулы. Цикл может присоединять один или несколько углеводородных радикалов различной длины.

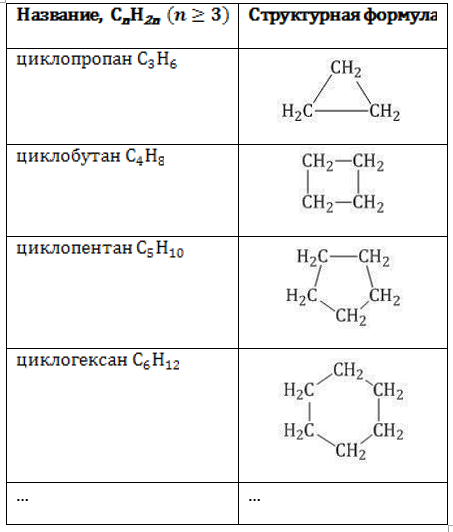
Простейшими карбоциклическими углеводородами являются циклоалканы, все атомы в которых соединены простыми σ-связями. Гомологический ряд с общей формулой ![]() открывается циклопропаном, в молекуле которого углеродные атомы расположены в углах треугольника. Циклобутан имеет молекулу в форме четырехугольника, циклопентан – пятиугольника и так далее:
открывается циклопропаном, в молекуле которого углеродные атомы расположены в углах треугольника. Циклобутан имеет молекулу в форме четырехугольника, циклопентан – пятиугольника и так далее:
Наименования циклоалканов строятся путем добавления приставки «цикло-» к названию алкана с соответствующим количеством углеродных звеньев в молекуле. Углерод в кольце не может присоединять более двух водородных атомов, и циклоалканы имеют одинаковый атомный состав ![]() с алкенами. Эти соединения представляют собой межклассовые изомеры.
с алкенами. Эти соединения представляют собой межклассовые изомеры.
Понятие об ароматических углеводородах
Помимо циклоалканов, к карбоциклическим соединениям принадлежат арены. Благодаря присущему многим из них специфическому сладковатому запаху эти углеводороды получили название ароматических.
Наиболее простой гомологический ряд аренов открывается бензолом ![]() , молекула которого образована замкнутой цепью из шести групп
, молекула которого образована замкнутой цепью из шести групп ![]() посредством химической связи особого типа между атомами углерода. Эту устойчивую структурную единицу – бензольное кольцо, или ядро – имеют в составе все ароматические углеводороды.
посредством химической связи особого типа между атомами углерода. Эту устойчивую структурную единицу – бензольное кольцо, или ядро – имеют в составе все ароматические углеводороды.
Тип связи, формирующий бензольное кольцо, характерен и для многих гетероциклических соединений, поэтому понимание ее природы важно для дальнейшего изучения химии органических веществ.
История открытия структуры бензола
Впервые бензол был получен в 1825 году в опытах М. Фарадея. К 60-м годам XIX века химикам удалось установить состав вещества – ![]() . Бензол должен был представлять собой сильно непредельное соединение, но такой вывод не согласовался с его химическими свойствами. В обычных условиях бензол не участвует в реакциях присоединения и не окисляется. Он вступает в реакции замещения, свойственные предельным углеводородам.
. Бензол должен был представлять собой сильно непредельное соединение, но такой вывод не согласовался с его химическими свойствами. В обычных условиях бензол не участвует в реакциях присоединения и не окисляется. Он вступает в реакции замещения, свойственные предельным углеводородам.
Кроме того, для превращения в насыщенный углеводород ![]() бензолу не хватает восьми водородных атомов. Однако насыщение происходит присоединением шести атомов с образованием циклогексана
бензолу не хватает восьми водородных атомов. Однако насыщение происходит присоединением шести атомов с образованием циклогексана ![]() :
:
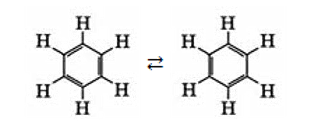
В 1865 году гипотезу о циклическом строении бензола выдвинул немецкий химик, автор теории валентности Ф.А. Кекуле. Он предположил, что бензольная молекула представляет собой шестиугольный цикл, в котором двойные и одинарные связи между углеродными атомами чередуются. Отсутствие изомерии у производных бензола с расположенными рядом радикалами Кекуле объяснил непрерывным перемещением двойных связей:
Формула Кекуле получила признание и нередко используется до сих пор. Однако она не дает объяснения химических особенностей бензола, которые были поняты только в XX веке с появлением электронной теории связи и модели гибридизации орбиталей.
Строение бензольного ядра
Углеродные атомы в составе бензольной молекулы располагаются в вершинах плоского правильного шестиугольника. Все связи в кольце (они называются ароматическими) равноправны и имеют одинаковую длину ![]() . Атомы находятся ближе друг к другу, чем в простой
. Атомы находятся ближе друг к другу, чем в простой ![]() связи (
связи (![]() ), и дальше, чем в двойной
), и дальше, чем в двойной ![]() -связи (
-связи (![]() ).
).
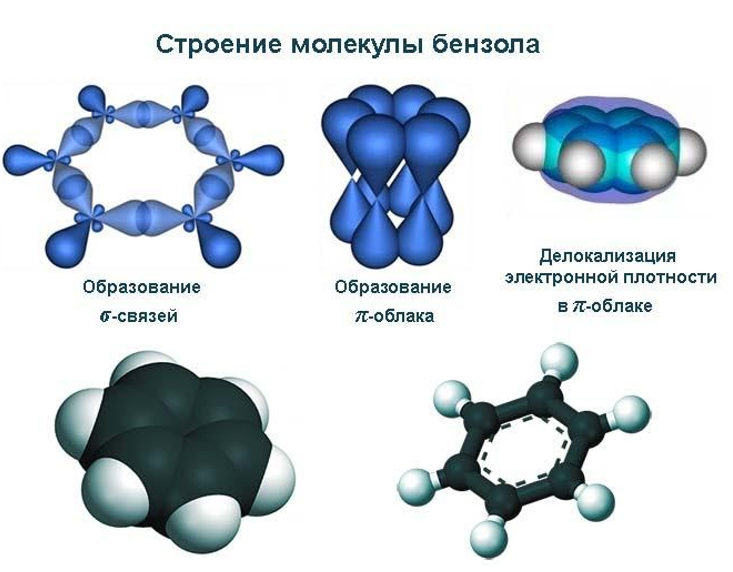
Углерод в бензоле гибридизован по типу sp2, то есть обладает тремя гибридными валентными электронными облаками, оси которых лежат в одной плоскости, и ориентированным перпендикулярно к ним негибридным p-облаком.
Каждый атом задействует две гибридных sp2-орбитали для образования двух ![]() -связей с соседними атомами. Поскольку все углы между sp2-орбиталями равны 120°, шесть атомов формируют шестиугольник правильной формы.
-связей с соседними атомами. Поскольку все углы между sp2-орбиталями равны 120°, шесть атомов формируют шестиугольник правильной формы.
Негибридное облако каждого углеродного атома вступает в боковое перекрывание с соседними p-облаками. В результате вместо трех ππ-связей формируется кольцевое единое облако шести обобществленных p-электронов с равномерно распределенной плотностью. Оно обеспечивает стабильность молекулы и отсутствие свойств, характерных для ненасыщенных углеводородов.
Для того чтобы подчеркнуть единство ππ-электронной системы бензольного ядра, в структурных формулах ее изображают в виде окружности внутри шестиугольника:
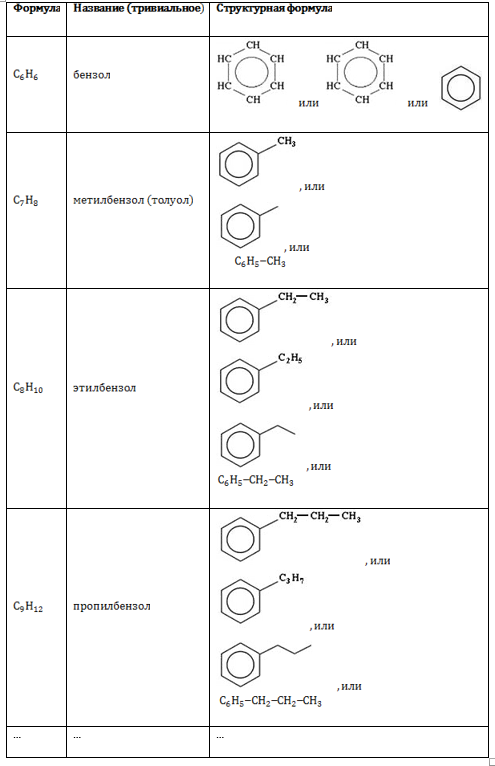
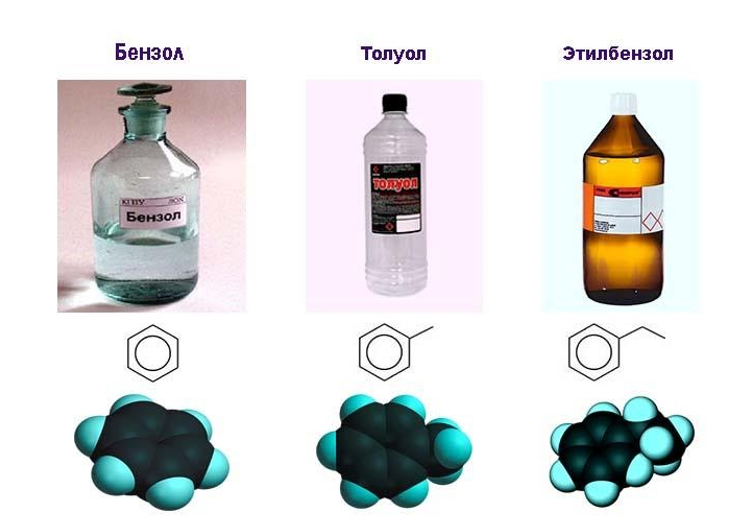
Гомологический ряд бензола
Состав соединений ряда бензола выражает общая формула ![]() Гомологи образуются замещением водородного атома бензольного ядра углеводородным радикалом:
Гомологи образуются замещением водородного атома бензольного ядра углеводородным радикалом:
Изомерия и номенклатура
Метилбензол не имеет изомеров, поскольку присоединяет лишь один метильный радикал ![]()
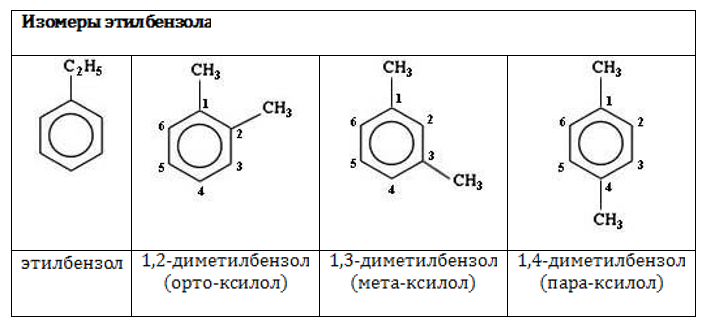
![]() , все положения которого равноправны. Начиная с этилбензола, ароматические углеводороды бензольного ряда обладают изомерией положения радикала (указывается цифрой в начале наименования):
, все положения которого равноправны. Начиная с этилбензола, ароматические углеводороды бензольного ряда обладают изомерией положения радикала (указывается цифрой в начале наименования):
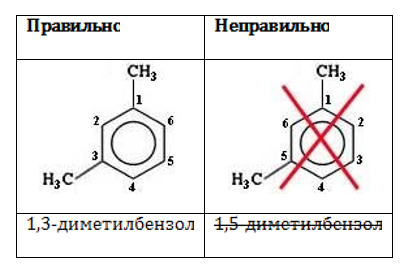
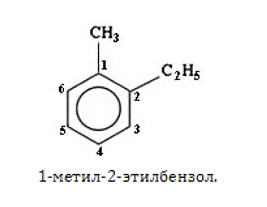
Количество одинаковых заместителей обозначается приставками «ди-», «три-», «тетра-» и так далее. Углеродные атомы нумеруются по ближайшему расположению заместителей:
Если в молекуле присутствуют разные по численному составу заместители, сначала указывается старший (более простой) из них:
Свойства бензола
Вследствие особого строения молекулы родоначальник ароматических углеводородов заметно отличается по свойствам от ациклических соединений и циклоалканов.
Физические свойства
В обычных условиях бензол – это бесцветная, легкая, практически нерастворимая в воде жидкость с резким запахом. Основные физические свойства приведены в таблице:
Химические свойства
В стандартных условиях бензол неохотно вступает в химические взаимодействия.
- Реакции замещения, протекающие без нарушения структуры ароматической связи, являются характерными для бензола.
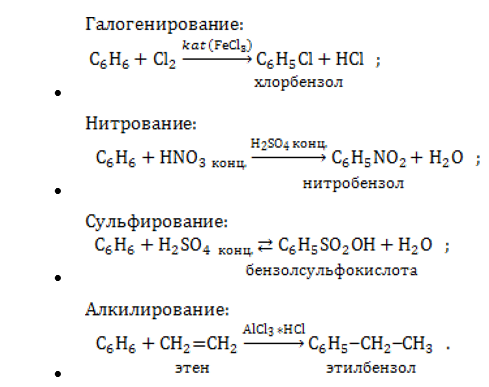
- Реакции присоединения требуют особых условий – повышенного давления и температуры, облучения ярким светом. При этом разрушается ароматическая связь.

- Бензол устойчив к окислению, в том числе раствором
 и разбавленной азотной кислотой, однако вступает в реакцию горения (полного окисления):
и разбавленной азотной кислотой, однако вступает в реакцию горения (полного окисления):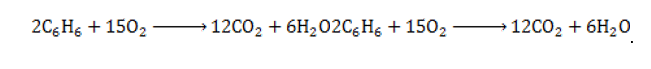
Это интересно:
Особенности гомологов бензола
Появление в молекуле ароматического углеводорода боковой цепочки воздействует на химические свойства, нарушая равноценность атомов в бензольном кольце. Но и радикал, в свою очередь, подвергается влиянию со стороны ароматического ядра.
Направляющее воздействие боковой цепи
В бензоле все углеродные атомы проявляют одинаковую реакционную способность, и на любом из них с равной вероятностью может происходить замещение водорода радикалом:
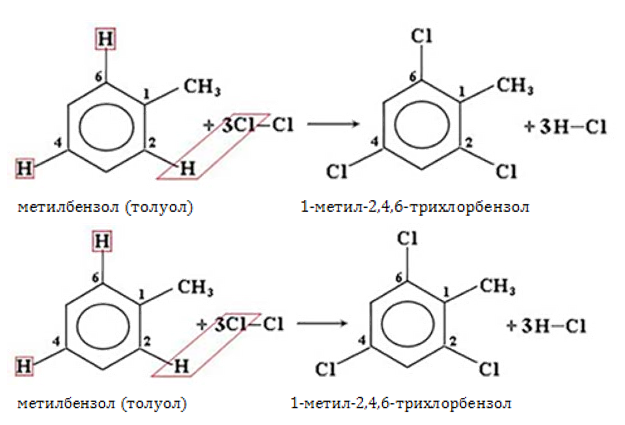
Присутствие заместителя изменяет состояние бензольного ядра. Теперь всякий новый заместитель не может вступить в любое положение. Боковая цепь оказывает ориентирующее воздействие, и по отношению к ней предпочтительными для реакции оказываются положения 2, 3 и 4:
Кроме того, наличие углеводородного радикала способствует снижению прочности бензольного ядра и облегчает процесс замещения. Реакции с участием гомологов бензола протекают с большей скоростью.
Влияние ароматического кольца на метильный радикал
Гомологи, в отличие от бензола, вступают и в реакции мягкого окисления, например, с раствором перманганата калия. При этом окисляется не ядро, а боковая цепь, связи в которой поляризуются под влиянием ядра. Наиболее полярной оказывается та связь![]() , которая находится ближе к бензольному кольцу.
, которая находится ближе к бензольному кольцу.
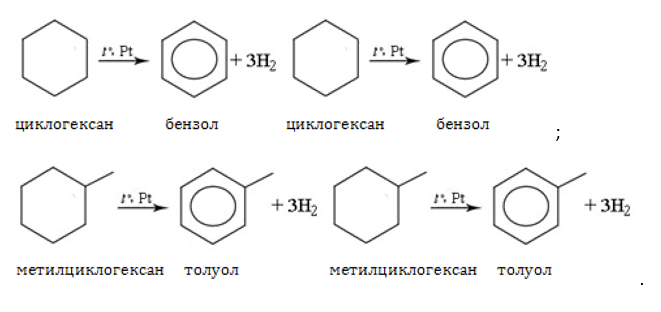
Получение углеводородов бензольного ряда
Существует несколько способов производства бензола и его гомологов.
В промышленности этот метод называется каталитическим риформингом.
Практическое значение циклических углеводородов
Значительная часть карбоциклических соединений применяется в качестве реагентов для синтеза других веществ.
- Циклоалканы используют для получения бензола и его гомологов, а также синтеза красителей, смазочных материалов и фармацевтических препаратов, и искусственных волокон. Наибольшее применение находят циклопентан, циклогексан, изомеры циклогептана и циклооктана.
- Ароматические углеводороды ряда бензола токсичны и применяются в основном как химическое сырье для получения различных химикатов: красок, пестицидов и инсектицидов, компонентов топлива (этилбензол), ионообменных смол.
Область применения циклических углеводородов широка, и они играют большую роль в производстве соединений, удовлетворяющих запросам многих отраслей хозяйства, науки и техники.