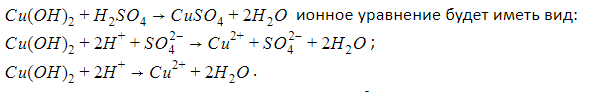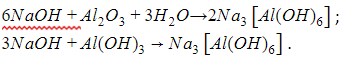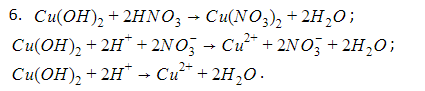Содержание
Основания в химии – совокупность соединений с характерной способностью к взаимодействию с кислотами, в результате которого происходит образование солей. Основания связаны с основными оксидами.
Определение. Структура и формула основания
Основания (основные гидроксиды) – соединения, образуемые связью между положительно заряженным ионом металла и высокореакционной гидроксильной группой – анионом OH-. В зависимости от валентности металла его ион может присоединять одну или несколько гидроксогрупп.
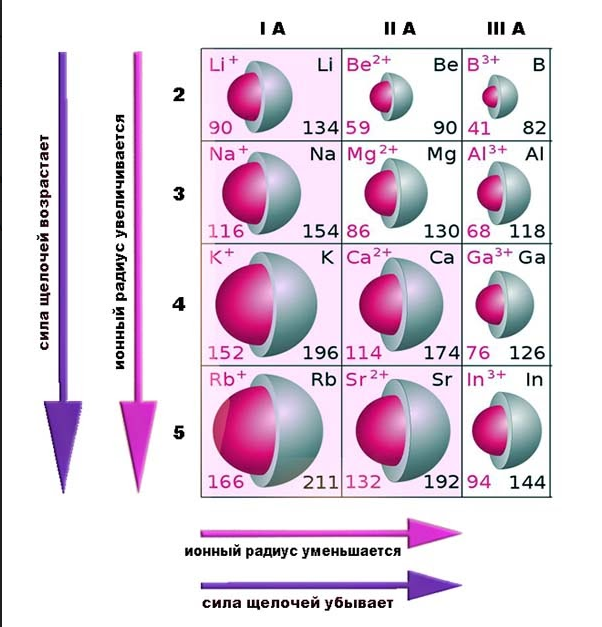
В составе основания катион металла и протон H+, входящий в гидроксогруппу, взаимно отталкиваются. Их удерживает притяжение к отрицательному иону кислорода O2-, причем протон расположен ближе и притягивается сильнее. Связь с металлом менее прочна, и ее величина определяется радиусом металлического иона.
Общий вид формулы основного гидроксида — MeOHn. Для определения величины n – количества гидроксогрупп, присоединяющихся к металлу, необходимо знать его степень окисления ![]() :
:
| натрий Na+ | n=1 | NaOH |
| железо(II) Fe2+ | n=2 | FeOH2 |
| железо(III) Fe3+ | n=3 | FeOH3 |
В качестве основания может рассматриваться гидрат аммиака (![]() ) в водном растворе, в этом случае формула данного соединения записывается как NH4OH.
) в водном растворе, в этом случае формула данного соединения записывается как NH4OH.
Номенклатура
Наименования оснований строятся по правилу: «гидроксид + название металла». Если степень окисления металла непостоянна, в названии указывается его валентность: гидроксид железа(III).
Некоторые основания имеют, помимо систематических, тривиальные (традиционные и технические) названия:
|
Основание |
Тривиальное название |
| гидроксид натрия NaOH | едкий натр; каустик (техн.) |
| гидроксид калия KOH | едкое кали; калиевый щелок |
| гидрат аммиака NH4OH (в растворе – гидроксид аммония) | аммиачная вода |
| гидроксид кальция Ca (OH2) | гашеная известь; пушонка |
| гидроксид бария Ba (OH2) (в растворе) | баритовая вода |
Классификация
Основания подразделяются по следующим признакам:
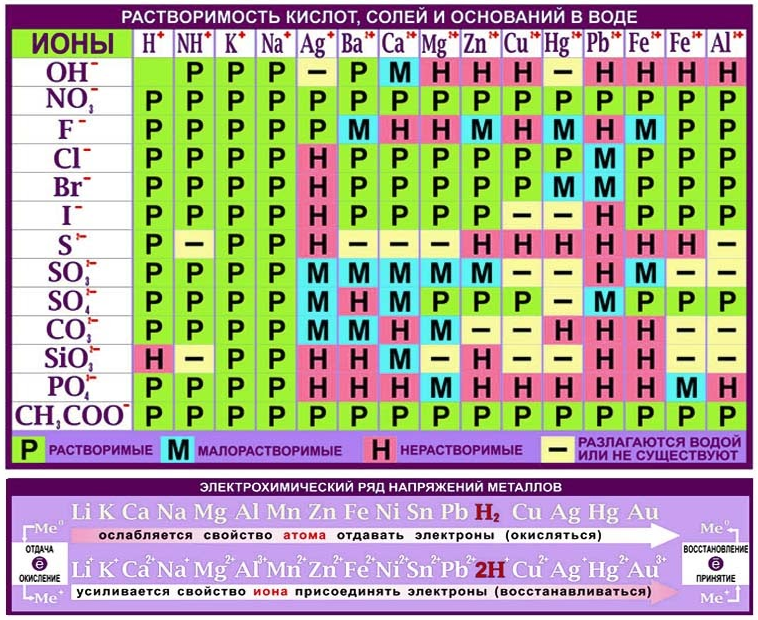
Растворимость в воде:
- растворимые – гидроксиды щелочных и щелочноземельных металлов, тяжелого металла таллия(I) TlOH, а также гидроксид аммония;
- нерастворимые.
Кислотность – количество n соединенных с металлом гидроксид-ионов OH-: одно-, двух-, трехкислотные.
Сила – способность к диссоциации, то есть отдаче гидроксид-ионов:
- сильные (все растворимые, за исключением гидроксида аммония, и малорастворимые гидроксиды щелочноземельных металлов кальция Ca(OH2) и стронция Sr(OH2);
- слабые (нерастворимые в воде основания и гидроксид аммония NH4OH).
Щелочи
К щелочам относят сильные основания, растворимые в воде. В отношении гидроксидов кальция и стронция понятие «щелочь» применяется к растворенной части:
Формула щелочи имеет вид ROH либо ROH2 в зависимости от степени окисления образующего ее металла R. Трехосновных щелочей не существует. В таблице представлены щелочи, образованные металлами разных групп периодической таблицы:
|
Металлы |
Гидроксиды |
Щелочные (I A):
|
«Едкие щелочи»:
LiOH NaOH KOH RbOH CsOH |
Щелочноземельные (II A):
|
Ca(OH2)
Sr(OH2) Ba(OH2) Ra(OH2) |
III A:
|
TlOH |
Чем больше радиус металлического катиона и чем меньше его заряд (степень окисления), тем слабее связь с гидроксогруппой OH- и, следовательно, тем сильнее основание. Наиболее сильные щелочи в химии – это гидроксиды цезия и радия: у этих металлов самые крупные ионы. Соответственно слабейшая из щелочей – гидроксид лития.
Свойства
В стандартных условиях основания – твердые вещества с кристаллическим строением, различных оттенков (чаще белые или бесцветные), без запаха. Едкие щелочи в твердом состоянии чрезвычайно гигроскопичны. Расплавы и растворы щелочей являются электролитами.
Водные растворы щелочей – мылкие жидкости, вызывающие изменение цвета индикаторов:
- лакмус: фиолетовый → синий;
- фенолфталеин: бесцветный → малиновый;
- метилоранж: оранжевый → желтый;
- универсальный: оранжевый → синий.
Концентрированные щелочные растворы опасны в обращении. При работе с ними необходимо использовать средства защиты и соблюдать технику безопасности. Едкие щелочи растворяются не только в воде, но также в метаноле и этаноле.
Химические свойства
1. В растворах и расплавах сильные основания диссоциируют:
Гидроксид аммония – неустойчивое соединение и самопроизвольно разлагается на аммиак и воду:
2. Взаимодействие с кислотами
Реакции нейтрализации между щелочью и кислотой, продуктами которых являются соль и вода:
Ионное уравнение: ![]() ; сокращенное
; сокращенное ![]() .
.
Слабое основание не диссоциирует, поэтому для реакции
- Реакция протекает не до конца при избытке одного из реагентов:
![]() – образуется основная соль сульфат гидроксомеди(II);
– образуется основная соль сульфат гидроксомеди(II);
![]() – образуется кислая соль дигидрофосфат натрия.
– образуется кислая соль дигидрофосфат натрия.
Если оба реагента слабые, реакция не идет.
3. Взаимодействие с оксидами и гидроксидами
- Между щелочью и кислотным оксидом с образованием соли и воды:
- Между щелочным расплавом и амфотерным оксидом либо гидроксидом:
- Между раствором щелочи и амфотерным оксидом (гидроксидом):
В реакциях этого типа образуется комплексная соль (здесь – гексагидроксоалюминат натрия).
Нерастворимые основания принадлежат к амфотерным гидроксидам: по отношению к сильным основаниям они обладают кислотными свойствами.
4. Между щелочью и растворимой солью протекает реакция обмена, если хотя бы один из продуктов выпадает в осадок:
Ионное уравнение: ![]() ; сокращенное –
; сокращенное – ![]() .
.
5. Участие в окислительно-восстановительных реакциях с металлами, не образующими основных оксидов (Be, Al, Zn, Sn), и с некоторыми неметаллами:
6. Разложение на оксид и воду при нагревании нерастворимых и малорастворимых оснований:
Легкорастворимые щелочи устойчивы к нагреванию, за исключением гидроксида лития.
Получение
Это интересно:
Применение
Физико-химические свойства оснований сделали их незаменимыми веществами во всех отраслях, использующих химические технологии:
- в добыче полезных ископаемых и металлургии;
- в производстве потребительских товаров, косметической, пищевой и фармацевтической продукции;
- в производстве красителей, бытовой химии и удобрений;
- в топливной и химической промышленности;
- в строительстве и многих других областях.
Наиболее широко применяются щелочи, но и нерастворимые основания используются в производстве полимеров, в очистных сооружениях, в медицине, в электротехнике.
Задания
1. Какое соединение в ряду KOH, Ra(OH2), BeO, P2O5, HBrO3, Al(OH3) является:
-
- амфотерным оксидом;
- едкой щелочью;
- кислотным оксидом;
- нерастворимым основанием;
- гидроксидом щелочноземельного металла?
2. Какое основание в каждой из пар является более сильным?
-
- Ca(OH)2 или Mg(OH)2;
- Ba(OH)2 или Ca(OH)2;
- Ra(OH)2 или CsOH;
- Sr(OH0)2 или Al(OH)3;
- KOH или LiOH.
3. Какие соединения образуются в результате реакции Zn(OH)2+H2SO4? Напишите ее молекулярное и ионное уравнения.
4. Какие соединения являются продуктом реакции между гидроксидом натрия и оксидом азота(V)? Напишите уравнения в молекулярной и ионной форме.
5. Какое основание можно получить, используя реакцию между гидроксидом калия и сульфатом магния? Запишите ее уравнения.
6. Составьте молекулярные и ионные уравнения реакций, позволяющих осуществить превращения ![]() .
.