Содержание
Количество углеродных атомов в цикле, образующем молекулу, влияет на свойства циклоалканов, проявляемые в различных видах химических взаимодействий. Соединения с малыми циклами, в которых существенную роль играет угловое напряжение, отличаются неустойчивостью и близки по свойствам к непредельным углеводородам. Чем больше звеньев в цикле, тем сильнее проявляются свойства, присущие алканам.
Реакции присоединения
Участие в процессах этого типа, связанных с разрывом замкнутого участка молекулы, свойственно циклопропану ![]() и циклобутану
и циклобутану ![]() , обладающим малыми циклами.
, обладающим малыми циклами.
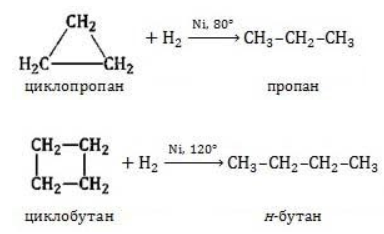
Гидрирование
Условиями реакции являются нагревание и присутствие катализатора. Цикл размыкается с образованием алкана:
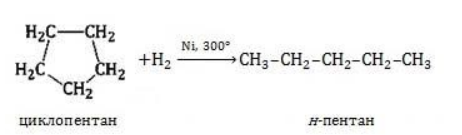
Для вступления в реакцию циклопентана требуются более жесткие условия:
Это единственная реакция присоединения, в которую способен вступать циклопентан. Сходство химических свойств циклоалканов с более высоким углеродным числом обусловливает их неучастие в реакциях присоединения.
Галогенирование
Продуктом этой реакции становится дигалогеналкан:
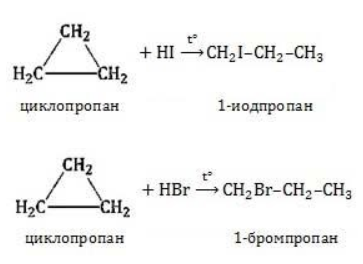
Гидрогалогенирование
Циклопропан реагирует в водном растворе с галогенводородами:
Присоединять галогенводород способны и гомологи циклопропана с углеводородным радикалом и трехчленным циклом. В процессах гидрогалогенирования циклоалканов соблюдается правило Марковникова, согласно которому водород присоединяется к максимально гидрогенизированному атому углерода:
Реакции замещения
Для циклоалканов со слабо напряженным или ненапряженным циклом (![]() ) характерно замещение водорода без разрушения цикла.
) характерно замещение водорода без разрушения цикла.
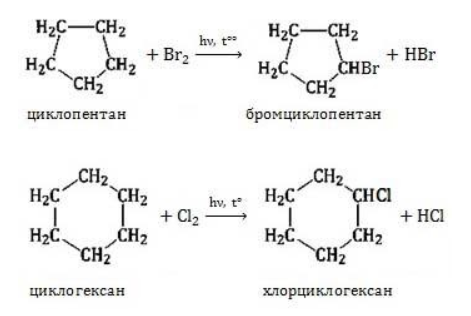
Галогенирование
В результате реакции образуется галогенциклоалкан:
Хлорирование малого цикла также может происходить без его разрыва, если температура реакции не превысит 100° C:
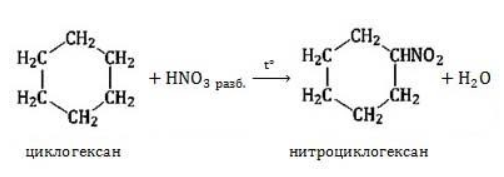
Нитрование
Азотная кислота должна быть разбавленной. Продукт взаимодействия – нитроциклоалкан:
Это интересно:
Окисление циклоалканов
Реакции окисления одинаково свойственны всем циклоалканам. Аналогично предельным незамкнутым углеводородам, они не реагируют с водным раствором ![]() , но подвергаются каталитическому окислению и горят, как все углеводороды.
, но подвергаются каталитическому окислению и горят, как все углеводороды.
Мягкое окисление
При мягком окислении воздухом на хлориде кобальта получают алициклические кислородсодержащие соединения (кетон и спирт):
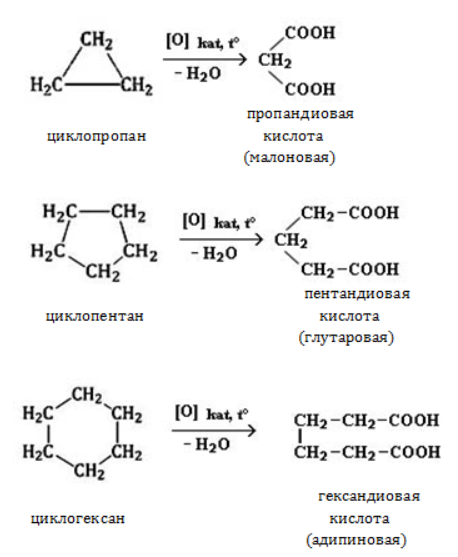
Жесткое окисление
С использованием катализатора воздействие сильного окислителя (например, разбавленной азотной кислоты) на циклоалкан приводит к образованию двухосновных кислот. Реакция протекает в жестких условиях:
Полное окисление (горение)
В общем виде уравнение горения циклоалканов записывается:
Инициирует реакцию контакт с открытым пламенем.
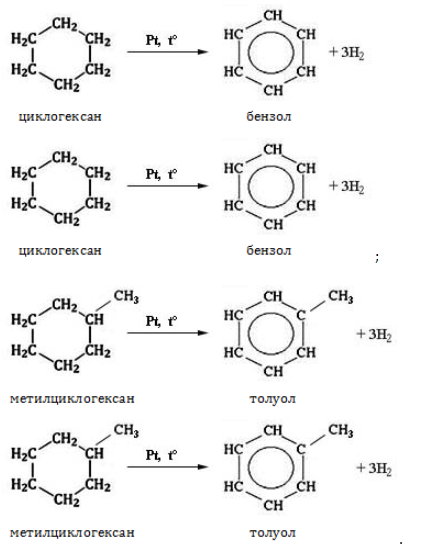
Реакция отщепления
Нагревание в присутствии металлического катализатора приводит к дегидрированию циклоалканов – отщеплению водорода и образованию ароматического соединения бензольного ряда:
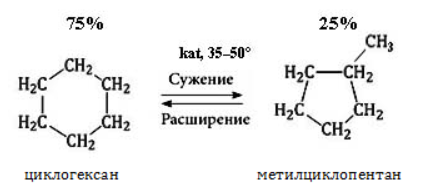
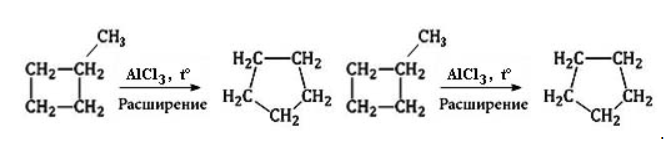
Изомеризация
Циклоалканы способны изомеризоваться с перегруппировкой атомов в углеродном скелете. Процесс протекает на платине, хлориде или бромиде алюминия и сопровождается сужением либо расширением цикла. Образование средних циклов происходит легче, и они отличаются большей устойчивостью:
Реакция идет в обоих направлениях до установления равновесия.
Для низших циклоалканов предпочтительной оказывается изомеризация с расширением цикла, так как она ведет к ослаблению углового напряжения в молекуле. Так, метилциклобутан переходит в циклопентан необратимо:
Заключение
Циклоалканы, находящиеся в начале гомологического ряда, сочетают в своих химических взаимодействиях свойства предельных и непредельных углеводородов линейного строения. Комбинация свойств вызвана, с одной стороны, особыми условиями образования непрочных изогнутых связей в простейших циклах, и, с другой стороны, насыщенностью соединений.
Высшие циклоалканы практически не отличаются по химическим свойствам от алканов, так как их макроциклы не оказывают деформирующего влияния на строение химических связей.




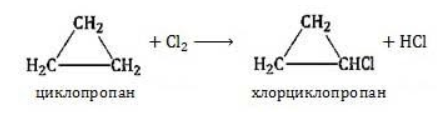

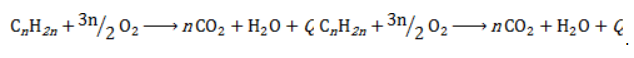


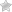 (голосов: 1, средняя оценка: 4,00 из 5)
(голосов: 1, средняя оценка: 4,00 из 5)